表面自由エネルギー 用語解説 Ⅱ
本日もあすみ技研接触角計コラムをご覧いただきありがとうございます。今回のコラムは「表面自由エネルギー用語解説 Ⅰ」の続きとなります。まだ読んでいない方はぜひ読んでみてください。それでは今回も最後までよろしくお願いします。
前回に引き続き早速用語を解説させていただきます。
双極子 dipole
双極子とは分子内での電荷の偏りのことを指し、永久双極子と誘起双極子、瞬間双極子に分類できます。
永久双極子 permanent dipole
極性分子のように分子の内的要因により継続的に発生する双極子のことを言います。
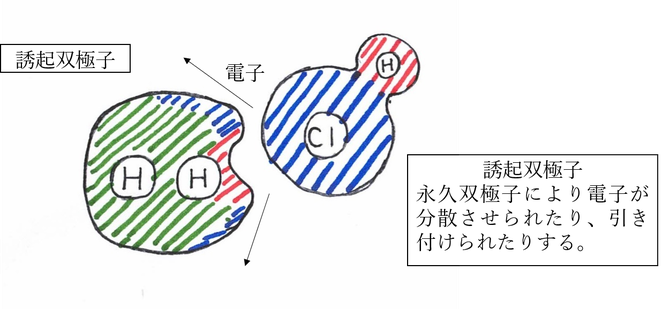
誘起双極子 induced dipole
元々電荷の偏りを持たない無極性分子等が極性分子などにより電場が乱され発生した双極子のことを言います。
瞬間双極子 momentary dipole
無極性分子に生じる瞬間的な双極子のこと。電子は原子の周りを飛び回っており電子雲として表現できます。電子雲が濃い場所は高い確率で電子が存在しており、逆に薄い場所では低い確率で電子が存在しています。確率としては低いですが電子の存在が原子や分子の一部の方向に偏っている瞬間が存在していて、これにより無極性分子にも電荷の偏りが極めて瞬間的にですが発生しています。

分子間結合力
原子が分子を形成する結合と比べて弱い力ですが、分子同士が結合を形成することがありこれを分子間結合といいます。原理としてはシンプルで、分子同士の双極子の正の部分と負の部分引き合うことで形成されます。分子間結合の力は結合の仕方や力の大きさによって分類でき、水素結合力やファンデルワールス力などがあります。ファンデルワールス力はさらに配向力、誘起力、分散力に細分化することができます。

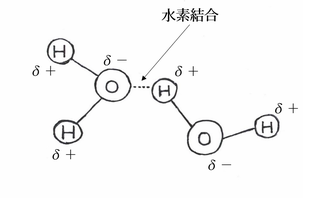
水素結合力 hydrogen bond
結合のメカニズムですが、水素原子は陽子と電子を一つしか持たず、ほかの原子と比較して小さいため、原子核周辺の電子雲が引き付けられたり分散することで部分的正電荷が発生すると、電荷密度が強くなります。この強い正電荷密度が結合先の分子の非共有電子対を引き付け、水素結合が形成されます。水素結合の力の強さですが、ほかの分子間力と比較してざっくりと10倍程度となっています。
ファンデルワールス力 van der Waals force
先ほど記述したようにファンデルワールス力は配向力、誘起力、分散力の3つに分類できます。基本的にはどれも分子内の双極子によって分子同士が引き合う力であり似たようなものですが、引き合う双極子の種類によってそれぞれ分類されます。
・配向力 dipole force
永久双極子同士によって形成される結合の力。
・誘起力 induction force
永久双極子と無極性分子によって形成される結合の力。無極性分子が永久双極子により電荷のバランスを乱されることで誘起双極子ができ、永久双極子と結合を形成する。
・分散力 dispersion force
無極性分子同士によって形成される結合の力。無極性分子の瞬間双極子同士が結合を形成する。ほかのファンデルワールス力と比較して弱い。
ここで水素結合力と配向力の違いについて混同される方がいると思うので説明します。結論から書くと結合力の大きさで分類されています。図を見てもらうとわかるように水素結合力は配向力と比較して10倍以上の力を持っています。これは水素原子が電子を一つしか持っておらず、電子雲が他の原子と比べて小さく原子核近辺で形成されていることに起因します。
【最後に】
単語解説は一旦これで以上となります。弊社サイト上で分かりにくい部分や、装置について詳しく聞いてみたいという方がいらっしゃいましたら、ぜひお気軽にお問い合わせください。それでは最後までお読みいただきありがとうございました。
(M.H)